Mit dem Alter nimmt die Regenerationsfähigkeit des Nervensystems ab; das Risiko für Nervenerkrankungen (Neuropathien) steigt. Forscher des Leibniz-Instituts für Alternsforschung in Jena haben mit Kollegen des Jenaer Universitätsklinikums und der Universität Bonn die Regeneration alternder Nerven untersucht. Sie fanden heraus, dass daran maßgeblich eine gestörte Immunantwort beteiligt ist, die zu einem chronischen Entzündungszustand führt. Zur Verbesserung der Nervenregeneration im Alter wiesen die Forscher die Wirksamkeit einer entzündungshemmenden Therapie nach und identifizierten vielversprechende Alternsmarker, die derzeit auf ihre Eignung als spezifische Therapieziele getestet werden.
Jena. Unzählige Nerven durchziehen den menschlichen Körper. Gemeinsam bilden sie das periphere Nervensystem, welches Gehirn und Rückenmark (das zentrale Nervensystem) mit dem Rest des Körpers verbindet, um Schmerz- und Sinneswahrnehmungen und Bewegungssignale weiterzuleiten. Störungen des peripheren Nervensystems haben große Auswirkungen auf die Lebensqualität und führen zu Beeinträchtigungen verschiedener Organfunktionen, reduzierter Sinneswahrnehmung und unspezifischem Schmerzempfinden. Umso wichtiger ist daher die gute Regenerationsfähigkeit, die einen lebenslangen Erhalt der Nervenfunktionen ermöglicht und sie nach Verletzungen wiederherstellt. Mit dem Alter nimmt diese Regenerationsfähigkeit jedoch ab, und mit ihr auch die Funktionalität des Nervensystems.
Obwohl die altersbedingt abnehmende Regenerationsfähigkeit bereits seit längerem bekannt ist, sind deren Ursachen größtenteils noch unerforscht und Therapien bisher schwierig bis unmöglich. Forscher des Leibniz-Instituts für Alternsforschung – Fritz-Lipmann-Institut (FLI) in Jena konnten nun zusammen mit Kollegen des Jenaer Universitätsklinikums und der Universität Bonn wichtige Einblicke in die zugrundeliegenden molekularen und zellulären Vorgänge des Alterns von Nerven erlangen und mögliche Therapieansätze identifizieren. Die Ergebnisse der Studie wurden kürzlich in der Fachzeitschrift Aging Cell veröffentlicht.
Chronische Entzündungsprozesse beeinträchtigen die Regeneration im Alter
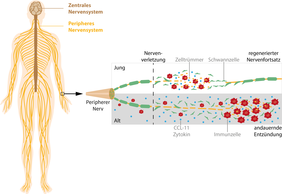
Die Forscher untersuchten zunächst die Regenerationsfähigkeit des peripheren Nervensystems im Mausmodell. Junge Mäuse regenerierten nach einer Nervenverletzung deutlich schneller als alte Mäuse und zeigten auch schneller eine vollständige Genesung. Alte Mäuse zeigten auch nach längerer Regenerationszeit keine vollständige Wiederherstellung der Nervenfunktionen.
„Das periphere Nervensystem ist ein sehr komplexes System, in dem verschiedene Zelltypen eng miteinander kommunizieren und zusammenarbeiten müssen,“ erläutert Dr. Helen Morrison, Forschungsgruppenleiterin am FLI. „Dies ist umso wichtiger beim Regenerationsprozess der Nerven, der zeitlich und räumlich hoch koordiniert ablaufen muss, um erfolgreich zu sein.“ Die Hauptdarsteller der Regeneration sind auswachsende Nervenzellen, unterstützende Schwannzellen sowie Immunzellen – insbesondere Fresszellen -, die helfen, den verletzten Nerv abzubauen und Zelltrümmer zu beseitigen, um den Platz für regenerierende Nerven zu schaffen.
Frühere Studien haben gezeigt, dass speziell die Funktion von Schwann- und Immunzellen durch den Alternsprozess beeinträchtigt wird. Forscher waren bisher davon ausgegangen, dass das gealterte Immunsystem in Folge einer Nervenverletzung nur unzureichend aktiviert werden kann, bzw. dass deren Zellfunktion herabgesetzt ist. Es wurde eine abgeschwächte Immunantwort als Ursache der verringerten Regeneration vermutet, die den Bereich der Verletzung für die regenerierenden Nerven nur unzureichend frei räumen kann.
„Dies scheint jedoch nur ein Teil der Geschichte zu sein“, so Robert Büttner, der das Thema im Rahmen seiner Doktorarbeit am FLI bearbeitete und Erstautor der Studie ist. „Wir beobachteten, dass die Immunantwort in Folge einer Nervenverletzung zwar zunächst verringert ist, bei näherer Beobachtung jedoch nur verzögert abläuft,“ so Büttner weiter. „Alte verletzte Nerven zeigen stattdessen im weiteren Verlauf eine verstärkte, überschießende Immunantwort, was zu einem Zustand andauernder Entzündung führt und den weiteren Heilungsprozess stark beeinträchtigt.“ Durch Gabe des Entzündungshemmers Acetylsalicylsäure (ASA, auch bekannt unter dem Markenname Aspirin®) gelang es den Forschern, dieser Entwicklung entgegenzuwirken und die Nervenregeneration bei alten Mäuse deutlich zu steigern.
Identifikation alternsassoziierter Entzündungsmarker – neue Therapieansätze
Das Team ging der Frage nach, wie die überschießende Immunantwort die Regeneration beeinträchtigt und untersuchte dafür gezielt die Botenstoffe, die die Kommunikation zwischen den beteiligten Zellen vermitteln. „Das Zytokin CCL-11 war für uns am interessantesten“, fasst Dr. Michael Reuter, Postdoktorand in der Forschungsgruppe Morrison, die Ergebnisse zusammen. Dieses Zytokin ist vor allem im Zusammenhang mit Allergien und der Parasitenabwehr bekannt; auch eine Rolle bei der alternsbedingten Abnahme kognitiver Leistung wurde beschrieben. „Eine Funktion bei der Nervenregeneration ist jedoch neu“, unterstreicht Dr. Reuter das Ergebnis.
Nachfolgend konnten die Forscher zeigen, dass CCL-11 auf die Schwannzellen einwirkt und deren Differenzierung verhindert, so dass sie nicht mehr in der Lage sind, die Regeneration optimal zu unterstützen. Diese Schwannzellen rekrutieren vermutlich beständig weiter neue Immunzellen, was den andauernden Entzündungszustand erklären könnte; ein Teufelskreis.
„Die Identifizierung einzelner, ursächlich beteiligter Signalmoleküle eröffnet in diesem Zusammenhang ganz neue Therapieansätze“, betont Dr. Morrison. „Im Gegensatz zu dem unspezifischen Entzündungshemmer ASA mit seinen bekannten Nebenwirkungen, haben wir hier die Möglichkeit, ganz präzise in den Regenerationsprozess einzugreifen.“ In diesem Zusammenhang ist besonders interessant, dass sowohl Mäuse als auch Menschen altersbedingt chronisch erhöhte CCL-11 Werte im Blut aufweisen. CCL-11 könnte somit ein spezifischer Alternsmarker sein. In weiteren Arbeiten prüfen die Forscher um Dr. Morrison nun, ob sich das Zytokin CCL-11 tatsächlich als therapeutisches Ziel eignet und zur Verbesserung der Nervenregeneration im Alter genutzt werden kann.
Publikation
Inflammaging impairs peripheral nerve maintenance and regeneration. Büttner R, Schulz A, Reuter M, Akula AK, Mindos T, Carlstedt A, Riecken LB, Baader SL, Bauer R, Morrison H. Aging Cell 2018, e12833. doi: 10.1111/acel.12833.
Hintergrundinformation
Das Leibniz-Institut für Alternsforschung – Fritz-Lipmann-Institut (FLI) in Jena widmet sich seit 2004 der biomedizinischen Alternsforschung. Über 330 Mitarbeiter aus 30 Nationen forschen zu molekularen Mechanismen von Alternsprozessen und alternsbedingten Krankheiten. Näheres unter http://www.leibniz-fli.de.
Die Leibniz-Gemeinschaft verbindet 93 selbständige Forschungseinrichtungen. Ihre Ausrichtung reicht von den Natur-, Ingenieur- und Umweltwissenschaften über die Wirtschafts-, Raum- und Sozialwissenschaften bis zu den Geisteswissenschaften. Leibniz-Institute widmen sich gesellschaftlich, ökonomisch und ökologisch relevanten Fragen. Sie betreiben erkenntnis- und anwendungsorientierte Forschung, auch in den übergreifenden Leibniz-Forschungsverbünden, sind oder unterhalten wissenschaftliche Infrastrukturen und bieten forschungsbasierte Dienstleistungen an. Die Leibniz-Gemeinschaft setzt Schwerpunkte im Wissenstransfer, vor allem mit den Leibniz-Forschungsmuseen. Sie berät und informiert Politik, Wissenschaft, Wirtschaft und Öffentlichkeit. Leibniz-Einrichtungen pflegen enge Kooperationen mit den Hochschulen – u.a. in Form der Leibniz-WissenschaftsCampi, mit der Industrie und anderen Partnern im In- und Ausland. Sie unterliegen einem transparenten und unabhängigen Begutachtungsverfahren. Aufgrund ihrer gesamtstaatlichen Bedeutung fördern Bund und Länder die Institute der Leibniz-Gemeinschaft gemeinsam. Die Leibniz-Institute beschäftigen rund 19.100 Personen, darunter 9.900 Wissenschaftlerinnen und Wissenschaftler. Der Gesamtetat der Institute liegt bei mehr als 1,9 Milliarden Euro (http://www.leibniz-gemeinschaft.de).
Originalpublikation:
Inflammaging impairs peripheral nerve maintenance and regeneration. Büttner R, Schulz A, Reuter M, Akula AK, Mindos T, Carlstedt A, Riecken LB, Baader SL, Bauer R, Morrison H. Aging Cell 2018, e12833. doi: 10.1111/acel.12833.