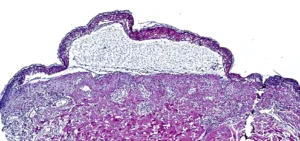
Räumliche Proteomik liefert Therapieansatz für Patienten mit toxischer epidermaler Nekrolyse
Einem internationalen Forscherteam vom Max-Planck-Institut für Biochemie ist eine bahnbrechende Entdeckung gelungen, die das Leben von Patienten mit toxischer epidermaler Nekrolyse retten könnte. Diese Erkrankung ist eine seltene, aber oft tödliche Nebenwirkung gängiger Medikamente, die zu großflächigen Hautablösungen führt. Mit räumlicher Proteomik konnte das Team den JAK/STAT-Signalweg als Hauptursache der Krankheit identifizieren. Die Forschenden haben die ersten sieben Patienten erfolgreich mit JAK-Hemmstoffen behandelt. Alle Patienten erholten sich schnell und vollständig.
In der aktuellen Studie nutzten Forschende am Max-Planck-Institut für Biochemie die räumliche Proteomik zur
Analyse von Hautproben von Patienten mit toxischer epidermaler
Nekrolyse. Dieser hochmoderne Ansatz, bekannt als Deep Visual
Proteomics, verbindet leistungsstarke Mikroskopie mit KI-gesteuerter
Analyse, lasergeführter Mikrodissektion und schließlich hochsensitiver
Massenspektrometrie. Die Forschenden untersuchten einzelne Zellen und
erstellten eine Karte von Tausenden Proteinen, die diese tödliche
Reaktion antreiben.
Thierry Nordmann, Erstautor und
Wissenschaftler am Max-Planck-Institut für Biochemie sowie Oberarzt in
der dermatologischen Klinik der Ludwig Maximilians Universität München
erklärt: „Durch die Anwendung räumlicher Proteomik auf archivierte
Patientenproben konnten wir einzelne Zelltypen präzise isolieren und
analysieren, was in der Haut der Patienten passiert. Wir haben eine
auffällige Überaktivierung des entzündungsfördernden JAK/STAT-Signalwegs
festgestellt und diese mit JAK-Hemmern behandelt. JAK-Inhibitoren sind
eine Klasse von Medikamenten, die bereits zur Behandlung anderer
entzündlicher Erkrankungen wie atopischer Dermatitis oder rheumatoider
Arthritis eingesetzt werden.“
Hohe Sterblichkeit
Toxische epidermale Nekrolyse ist eine seltene, aber äußerst schwere Nebenwirkung gängiger Medikamente wie Allopurinol (ein Mittel zur Behandlung von Gicht) oder bestimmter Antibiotika. Sie verursacht großflächige Blasenbildung und Ablösung der Haut. Mit einer Sterblichkeitsrate von bis zu 30 Prozent entwickelt sich der scheinbar harmlose Ausschlag schnell zu einer lebensbedrohlichen Erkrankung. Bislang gab es keine wirksame Therapie, die Behandlung beschränkte sich hauptsächlich auf unterstützende Maßnahmen, wie z.B. auf die Linderung von Schmerzen und Vermeidung von Infektionen.
Das Team analysierte die Ergebnisse anhand einer Reihe von präklinischen Studien, einschließlich In-vitro-Modelle und zwei unterschiedlicher Mausmodelle. Die Ergebnisse waren durchweg positiv: JAK-Inhibitoren zeigen echtes Potenzial bei der Behandlung dieser verheerenden Erkrankung. Die Entdeckungen, die durch eine globale Zusammenarbeit über sechs Länder hinweg erzielt wurden, demonstrieren die Effektivität internationaler Zusammenarbeit bei der Bewältigung drängender medizinischer Herausforderungen.
Neue Therapie für Patient:innen?
In Kooperation mit klinischen Teams unter der Leitung von Chao Ji am First Affiliated Hospital der medizinischen Universität Fujian in China verabreichte das Forschungsteam JAK-Inhibitoren an Patienten mit toxischer epidermaler Nekrolyse. Bemerkenswerterweise zeigten alle sieben behandelten Patienten eine rasche Verbesserung und vollständige Genesung.
Lars French, Ko-Korrespondenzautor und Lehrstuhlinhaber für Dermatologie an der LMU München, erläutert: „Die neuen Beweise, dass die Hemmung des JAK/STAT-Signalwegs das Potenzial hat, die hohe Sterblichkeit dieser schweren kutanen Arzneimittelreaktion zu reduzieren, ebnet den Weg für klinische Studien zur Zulassung von JAK-Inhibitoren, um einen der bedeutendsten, ungedeckten medinizinischen Bedarfe zu lösen.“
Obwohl größere klinische Studien erforderlich sind, um die Wirksamkeit und Sicherheit von JAK-Inhibitoren bei toxischer epidermaler Nekrolyse zu bestätigen, bietet diese Studie Hoffnung für Patientinnen und Patienten. Sie eröffnet auch neue Möglichkeiten für die alternative Nutzung und Entwicklung von Medikamenten. Die Max-Planck-Gesellschaft hat gemeinsam mit der Ludwig-Maximilians-Universität ein Patent für den Einsatz von JAK-Inhibitoren zur Behandlung von toxischer epidermaler Nekrolyse und verwandten Erkrankungen angemeldet. Damit eröffnet sich ein Potenzial für die Weiterentwicklung.
Matthias Mann fasst zusammen: „Unsere Ergebnisse eröffnen nicht nur neue Wege zur Behandlung von TEN, sondern unterstreichen auch das Potenzial der räumlichen Proteomik, medizinische Durchbrüche voranzutreiben. Unseres Wissens nach ist dies das erste Mal, dass eine räumliche Omics-Technologie eine unmittelbare und greifbare Auswirkung in der Klinik hatte, indem sie eine Behandlung identifizierte, die bereits das Leben von Menschen zum Guten verändert hat. Dieser Ansatz könnte auf eine Vielzahl von Krankheiten angewendet werden und potenziell die Medikamentenentdeckung in vielen Bereichen der Medizin beschleunigen.“
Glossar:
Deep Visual Proteomics: eine Methode der räumlichen Proteomik, die im Labor von Matthias Mann entwickelt wurde. Die Methode kombiniert moderne Mikroskopie, künstliche Intelligenz, Lasermikrodissektion und ultrasensitive Massenspektrometrie.
JAK-Hemmer: auch JAK-Inhibitoren genannt, sind Arzneimittel, die das JAK-Protein (Januskinase) hemmen und so den JAK/STAT-Signalweg blockieren.
JAK/STAT-Signalweg: ein in den Zellen vorkommender Signalweg, an dem das JAK-Protein (Januskinase) und das STAT-Protein (Signal Tranducers and Activator of Transcription) beteiligt sind. Dieser Signalweg ist für verschiedene zelluläre Prozesse, einschließlich Entzündungen, Zellwachstum und Differenzierung, wichtig.
Massenspektrometrie: analytische Technik, die Ionen nach ihrem Masse-zu-Ladung-Verhältnis trennt und misst, um chemische Substanzen oder Moleküle zu identifizieren und zu quantifizieren. Es handelt sich um eine grundlegende Technologie in der Proteomik, die die Identifizierung und Quantifizierung tausender Proteine in komplexen biologischen Proben ermöglicht.
Mikrodissektion: mikroskopisches Verfahren, bei dem einzelne Zellen oder Zellgruppen aus einem Gewebeschnitt mithilfe eines Lasers ausgeschnitten werden.
Omics-Technologie: Sammelbegriff für eine Gruppe von Methode in der Biotechnologie und Biologie, die die globale Analyse von Biomolekülen in biologischen Systemen ermöglichen. Die Methodik hat das Potential den Gesamtzusammenhang von biologischen Systemen zu zeigen. Häufige „Omics“-Technologien sind: Genomics: untersucht das gesamte Genom, also die Gesamtheit der DNA in einer Zelle; Transcriptomics: analysiert das gesamte Set an RNA-Molekülen, die in einer Zelle produziert werden. Proteomics: untersucht das gesamte Set an Proteinen, das von einer Zelle oder einem Organismus produziert wird. Metabolomics: ist die Studie aller metabolischen Produkte (Metaboliten) in einer Zelle und Epigenomics: befasst sich mit der Gesamtheit aller epigenetischen Modifikationen in einem genetischen Material.
Proteom: umfasst die Gesamtheit aller Proteine in einem Lebewesen, einem Gewebe oder einer Zelle zu einem bestimmten Zeitpunkt. Das Proteom ist hoch dynamisch und reagiert auf die Anforderungen der Zelle, sowie auf Krankheiten oder Umwelteinflüsse.
Proteomik: Erforschung des Proteoms