Freiburger Wissenschaftler entschlüsseln, welche Rolle Nanostrukturen bei der Funktion des Nervensystems spielen
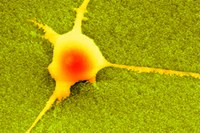
Elektronenmikroskopie einer Nervenzelle im direkten Kontakt mit nanorauer Oberfläche. Quelle: Nils Blumenthal und Prasad Shastri
Eine Ursache der Alzheimer-Krankheit sind Proteinablagerungen im Gehirn: Beta-Amyloid sammelt sich in so genannten Plaques an und sorgt dafür, dass Nervenzellen absterben. Bislang wussten Forscherinnen und Forscher wenig darüber, welche Rolle die Struktur des die Neuronen umgebenden Hirngewebes bei der Krankheit spielt. Wie beeinflussen Makromoleküle und makromolekulare Anordnungen, beispielsweise Mehrfachzucker, sowie Zellen aus dem Stützgerüst der Nervenzellen die Interaktion der Zellen im Gehirn? Prof. Dr. Prasad Shastri und der Doktorand Nils Blumenthal haben in Zusammenarbeit mit Prof. Dr. Bernd Heimrich und Prof. Dr. Ola Hermanson gezeigt: Die Beschaffenheit von Makromolekülen oder Stützgerüst-Zellen, zu denen Astrozyten gehören, spielt eine entscheidende Rolle bei der gesunden Interaktionen zwischen Hirnzellen im Hippocampus. Die Forschungsergebnisse hat das Team in der Fachzeitschrift „Proceedings of the National Academy of Sciences“ veröffentlicht.
Der Hippocampus gilt als das GPS-System des Gehirns: Er verarbeitet und speichert räumliche Informationen. Bei der Alzheimer-Krankheit bilden sich die Neuronen im Hippocampus zurück. Nehmen die umliegenden Moleküle oder Stützgerüst-Zellen eine zufällige, raue Struktur an, die Rüschen ähnelt, fördert und erhält dies die Kommunikation der Nervenzellen. „Lange nahmen Forscher an, dass nur biologische Signale die Gesundheit und die Funktion von Hirnzellen beeinflussen. Wir haben gezeigt, dass die Struktur der Moleküle, die diese Zellen umgeben, ebenso wichtig ist“, sagt Shastri.
Die Wissenschaftler fanden heraus, dass die Rauheit im Nanobereich innerhalb bestimmter Grenzen liegen muss. Gibt es mehr oder weniger der rauen Struktur, verändern sich die Nervenzellen so, dass sie ihre Funktion nicht mehr ausüben können. Shastris Team untersuchte menschliche Hirnzellen von Patientinnen und Patienten, die an Alzheimer erkrankt waren. Die Forscher entdeckten eine entscheidende Verbindung zwischen Regionen im Gehirn, in denen sich Beta-Amyloid angesammelt hatte, und unvorteilhaften Veränderungen in der Nanotopografie des Gewebes um die betroffenen Nervenzellen herum. Die Beschaffenheit der Oberfläche des Gewebes hatte sich verändert.
Das Team fand heraus, dass Astrozyten im Nanobereich eine physikalische Umgebung schaffen, die Nervenzellen brauchen, um gut zu funktionieren. Die Forscher setzten für ihre Experimente mit Neuronen synthetische Substrate mit unterschiedlicher Rauheit ein. „Unsere Entdeckung zeigt erstmals: Ionenkanäle, die auf Bewegungsreize reagieren, könnten Funktion und Erkrankung des zentralen Nervensystems beeinflussen. Die Ergebnisse deuten auf neue Angriffsziele für die Entwicklung von Medikamenten hin“, sagt Blumenthal. Moleküle, die ein mechanischer Reiz aktiviert, wie der Ionenkanal Piezo-1 in Hirnzellen von Mäusen, steuern das Zusammenspiel von Nanotopografie, Astrozyten und Nervenzellen. Frühere Forschungen haben gezeigt, dass MIB-1 – das Gegenstück von Piezo-1 in den Zellen des Menschen – in menschlichen Alzheimer-Patienten verändert ist.
Prasad Shastri forscht am Institut für Makromolekulare Chemie und am Exzellenzcluster BIOSS Centre for Biological Signalling Studies der Universität Freiburg. Der Doktorand Nils Blumenthal wird von BIOSS gefördert. Bernd Heimrich forscht am Institut für Anatomie und Zellbiologie der Albert-Ludwigs-Universität. Ola Hermanson arbeitet am Karolinska Institut der Universität Stockholm/Schweden.
Originalpublikation:
Nils Blumenthal, Ola Hermanson, Bernd Heimrich and V. Prasad Shastri. (2014) Stochastic Nanoroughness Modulates Neuron-Astrocyte Interactions and Function via Mechanosensing Cation Channels, Proc. Natl. Acad. Sci. USA. www.pnas.org/cgi/doi/10.1073/pnas.1412740111
