Metalle aus Endoprothesen können sich im Knochen ablagern
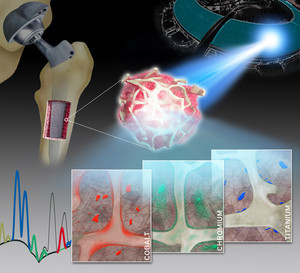
von humanen Knochen- und Knochenmark-Biopsien
Berlin, 11.08.2020 Eine Forschungsgruppe der Charité – Universitätsmedizin Berlin konnte mithilfe hochkomplexer Analysemethoden detailliert nachverfolgen, wie verschiedene Metalle aus Endoprothesen freigesetzt werden und sich im umliegenden Knochengewebe anreichern. Auch unabhängig von mechanischer Belastung kann es – anders als bisher angenommen – aus verschiedenen Prothesenteilen zu einer ständigen Freisetzung von Metallen kommen. Die im Fachmagazin Advanced Science veröffentlichen Erkenntnisse sollen helfen, die Materialien von Implantaten zu optimieren und ihre Sicherheit zu erhöhen.
Bevor man sich eine Prothese einsetzen lässt, sollte man überprüfen, ob es Alternativen zur OP gibt. Zum Beispiel die Biokinematik.
Der Arzt Claus Becker aus Badenweiler praktiziert die Biokinematik seit vielen Jahren. In Bad Krozingen gibt es die Klinik für Biokinematik.
Moderne Endoprothesen sollen Patienten mit chronisch degenerativen Gelenkerkrankungen eine schmerzfreie Beweglichkeit ermöglichen und so ihre Lebensqualität deutlich verbessern. Für solchen künstlichen Gelenkersatz werden Materialien mit verschiedenen Metallverbindungen verwendet, um eine mechanische Stabilität des Implantats möglichst lange zu gewährleisten. Entscheidend für den langfristigen Erfolg einer Endoprothese ist jedoch eine stabile Integration in das umliegende Knochengewebe. Frühere Arbeiten zur Implantatstabilität belegten, dass es an den Reibungsflächen, so genannte Gleitpaarungen, zu einem Abrieb von Metallen kommen kann. Diese Metallrückstände können zu einer Rückbildung des umliegenden Knochens, der sogenannten Osteolyse, und somit zu einer frühzeitigen Lockerung der Implantate führen. Allerdings wurde eine mögliche ständige Freisetzung von Metallen aus anderen Teilen der Prothese bisher außer Acht gelassen.
Die Forschungsgruppe um Dr. Sven Geißler am Julius-Wolff-Institut für Biomechanik und Muskuloskeletale Regeneration der Charité hat nun die räumliche Verteilung und lokale Toxikokinetik von freigesetzten metallischen Verschleiß- und Korrosionsprodukten im umliegenden Knochengewebe unter Verwendung eines einzigartigen Synchrotron-basierten Röntgenfluoreszenz-Bildgebungssystems detailliert untersucht. „Mit unserer Arbeit zeigen wir zum ersten Mal, dass sowohl partikuläre als auch gelöste Metalle, die aus Endoprothesen stammen, im umliegenden Knochen und im Knochenmark in überphysiologischen Konzentrationen vorhanden sind“, sagt Dr. Geißler. „Die kollagenhaltige Schicht, die nach der Operation das Implantat verkapselt, isoliert dieses somit nicht in dem Ausmaß vom menschlichen Gewebe wie bisher angenommen.“
Die Forschenden untersuchten hierfür winzige Knochenproben von 14 Patienten, bei denen ein Hüft- oder Kniegelenk ersetzt werden musste. Sie nutzten hierfür die Röntgenfluoreszenzanalyse, um die elementare Zusammensetzung der Proben qualitativ und quantitativ zu bestimmen. Diese Technik gestattet einzigartige Einblicke hinsichtlich Konzentration, Verteilung, Lokalisierung und Anreicherung von metallischen Abbauprodukten wie Kobalt, Chrom oder Titan im angrenzenden Knochen und im Knochenmark. Die notwendige sehr reine und fokussierte Röntgenstrahlung hoher Intensität wurde durch die Synchrotronstrahlungsquelle des Teilchenbeschleunigers der European Synchrotron Radiation Facility (ESRF) im französischen Grenoble erreicht und erlaubt eine weltweit einmalige Ortsauflösung von bis zu 30 Nanometer. „Im Rahmen unserer Arbeit bringen wir also eine klinisch hochrelevante Fragestellung und einen hochkomplexen experimentellen Aufbau zusammen“, erklärt Dr. Janosch Schoon, Erstautor der Studie.
„Unsere Studie leistet einen wesentlichen Betrag zur Verbesserung der Risiko-Nutzen-Bewertung von Medizinprodukten und zeigt, dass diese nicht nur Biokompatibilitätstests von Ausgangsmaterialien, sondern auch von deren späteren Verschleiß- und Korrosionsprodukten umfassen sollte. Auf diese Weise tragen die aktuellen Daten entscheidend dazu bei, die Implantatsicherheit auf dem höchstmöglichen Niveau zu halten“, resümiert Dr. Geißler. Basierend auf den Erkenntnissen sollen in nachfolgenden Untersuchungen die biologischen Konsequenzen der Metallfreisetzung im Knochen und Knochenmark erforscht werden. Zugleich werden neue Ansätze entwickelt, die eine zuverlässige präklinische Testung von Implantatmaterialien in humanen Zellen und im Labor gezüchteten Geweben erlauben.
*Schoon J et al. Metal-specific biomaterial accumulation in human peri-implant bone and bone marrow. Adv Sci (2020), DOI: 10.1002/advs.202000412
Originalpublikation
Julius Wolff Institut für Biomechanik und Muskuloskeletale Regeneration

