Forscher zeigen, wie die Toxine des resistenten Bakteriums Clostridium difficile in Darmzellen eindringen
Die Therapie bakterieller Infektionen mit Antibiotika schädigt häufig die Darmflora und führt zu Durchfall und Darmentzündungen. Oftmals sind Bakterien mit dem Namen Clostridium difficile, die gegen Antibiotika resistent sind, dafür verantwortlich. Eine Arbeitsgruppe um Prof. Dr. Dr. Klaus Aktories vom Institut für Experimentelle und Klinische Pharmakologie und Toxikologie der Universität Freiburg hat in Zusammenarbeit mit Prof. Dr. Andreas Schlosser vom Rudolf-Virchow-Zentrum in Würzburg gezeigt, wie die giftigen Proteine des Keims in die Darmzellen eindringen. Ihre Ergebnisse haben die Forscher in dem renommierten Journal „Proceedings of the National Academy of Sciences“ veröffentlicht.
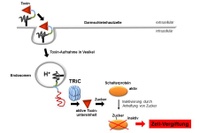
Das Bakterium Clostridium difficile produziert im Darm Giftstoffe, die in die Zellen der Schleimhaut eindringen und deren Schrankenfunktion stören. Wie diese Toxine in den Zellen wirken, ist seit Langem bekannt: Sie übertragen Zucker auf Schalterproteine, die dadurch inaktiv werden. In der Folge wird der Zusammenhang von Darmzellen gestört und es kommt zum Zelltod. Wie die vergleichsweise großen Proteine dieser Toxine in die Wirtszellen eindringen, war bisher nicht geklärt. Bekannt war lediglich, dass die bakteriellen Giftstoffe an Rezeptoren auf der Oberfläche von Darmzellen binden und aus Bläschen im Zytoplasma, den so genannten Vesikeln, durch kleine Poren ins Zellinnere gelangen.
Wie die Arbeitsgruppe gezeigt hat, hängt die weitere Aufnahme der Toxine von dem Protein TRiC ab. Es faltet Eiweißstoffe, die in der Zelle als lange Ketten von Aminosäuren gebildet werden, und verhilft ihnen zu ihrer räumlichen Struktur. Den Wissenschaftlern zufolge ist TRiC auch daran beteiligt, bakterielle Giftstoffe zu falten, die als lange Ketten durch Zellmembranen geschleust und dann im Inneren neu gefaltet werden müssen. Blockierten die Forscher TRiC durch einen Hemmstoff oder schalteten das Protein mit diesem genetisch aus, kam es zu keiner Vergiftung durch die Toxine.
Auch die Wirkung anderer bakterieller Giftstoffe, die alle die Fähigkeit haben, Zucker zu übertragen, hängen von TRiC ab. Die neuen Erkenntnisse können dabei helfen, Wirkstoffe gegen die Toxine zu entwickeln.
Originalpublikation
Marcus Steinemann, Andreas Schlosser,
Thomas Jank, and Klaus Aktories. The chaperonin TRiC/CCT is essential
for the action of bacterial glycosylating protein toxins like Clostridium difficile toxins A and B. Proceedings of the National Academy of Sciences USA. pii: 201807658. doi: 10.1073/pnas.1807658115.
