Studienergebnisse belegen Vorteile der Telemedizin
für Patienten mit Herzschwäche
Berlin, 27.08.2018 Die telemedizinische Mitbetreuung von Patienten mit Herzschwäche führt zu weniger Krankenhausaufenthalten und zu einer längeren Lebensdauer. Dies gilt gleichermaßen für Patienten im ländlichen Raum und in Metropolregionen. Das haben Wissenschaftlerinnen und Wissenschaftler der Charité – Universitätsmedizin Berlin herausgefunden. Die Ergebnisse wurden jetzt in der Fachzeitschrift Lancet* veröffentlicht.
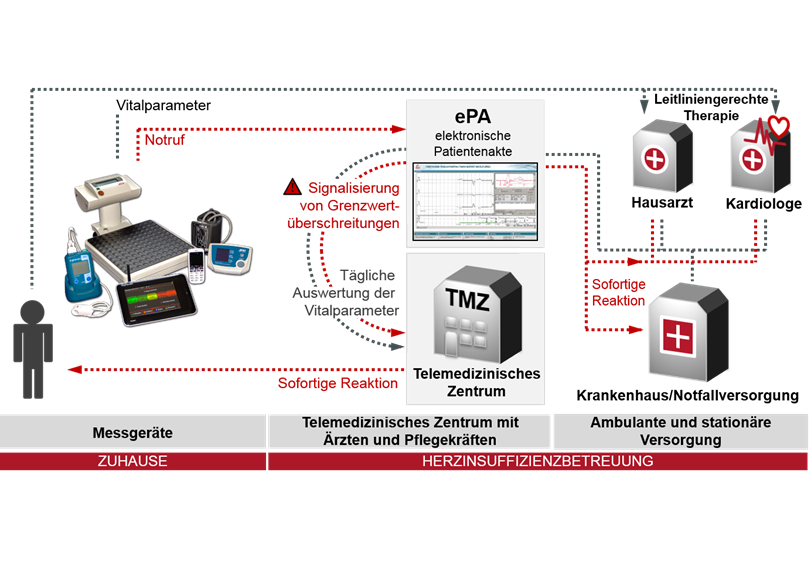
Im Rahmen des Forschungsprojektes „Gesundheitsregion der Zukunft Nordbrandenburg – Fontane“ hat das Team um Prof. Dr. Friedrich Köhler vom Zentrum für kardiovaskuläre Telemedizin der Charité 1.538 Patienten mit chronischer Herzinsuffizienz untersucht. Die Hälfte von ihnen wurde telemedizinisch mitbetreut, die andere Hälfte wurde konventionell behandelt. Die klinische Studie wurde bundesweit zusammen mit 113 kardiologischen und 87 hausärztlichen Einrichtungen durchgeführt.
Die telemedizinisch mitbetreuten Patienten erhielten vier Messgeräte: ein Elektrokardiogramm (EKG) mit Fingerclip zur Messung der Sauerstoffsättigung, ein Blutdruckmessgerät, eine Waage sowie ein Tablet zur Selbsteinschätzung des Gesundheitszustandes. Über das Tablet wurden die Werte automatisch an das Zentrum für kardiovaskuläre Telemedizin der Charité übertragen. Ärzte und Pflegekräfte des Zentrums bewerteten die übertragenen Messwerte – 24 Stunden täglich, sieben Tage die Woche. Bei einer Verschlechterung der Werte ergriffen sie entsprechende Maßnahmen, zum Beispiel die Veränderung der Medikation, die Empfehlung für einen ambulanten Arztbesuch oder die Krankenhauseinweisung. Primäre Studienziele waren, ungeplante kardiovaskuläre Krankenhausaufnahmen zu vermeiden und die Patienten möglichst lange außerhalb eines Krankenhauses behandeln zu können sowie die Lebenserwartung zu erhöhen. Weitere Studienziele umfassten die Erhöhung der Lebensqualität und der Selbstmanagementfähigkeit der Patienten. Zudem sollte überprüft werden, ob telemedizinische Mitbetreuung strukturelle Defizite der medizinischen Versorgung auf dem Land gegenüber städtischen Regionen ausgleichen kann.
Die Studienergebnisse zeigen, dass die telemedizinisch mitbetreuten Patienten weniger Tage durch ungeplante Einweisungen aufgrund von Herzinsuffizienz im Krankenhaus verbringen mussten: im Durchschnitt waren es 3,8 Tage pro Jahr im Vergleich zu 5,6 Tagen pro Jahr in der Kontrollgruppe. Damit haben die telemedizinisch mitbetreuten Patienten insgesamt und bezogen auf die einjährige Studiendauer pro Patient signifikant weniger Tage durch ungeplante kardiovaskuläre Krankenhausaufenthalte oder Tod verloren: 17,8 Tage im Vergleich zu 24,2 Tagen in der Kontrollgruppe. Darüber hinaus wies die telemedizinische Patientengruppe eine signifikant geringere Gesamtsterblichkeit im Vergleich zur Kontrollgruppe auf. Von 100 Herzinsuffizienzpatienten starben in einem Jahr unter den regulären Bedingungen etwa 11 Patienten (11,3 pro 100 Patientenjahre), mit telemedizinischer Mitbetreuung hingegen etwa 8 Patienten (7,8 pro 100 Patientenjahre).
„Die Studie konnte nachweisen, dass mit Telemedizin eine Lebensverlängerung erreicht werden kann“, erklärt Prof. Köhler. Dieses Ergebnis wurde unabhängig davon erreicht, ob der Patient in einer strukturschwachen ländlichen Gegend oder in einer Metropolregion lebt. Damit eignet sich Telemedizin, um regionale Versorgungsunterschiede zwischen Stadt und Land auszugleichen und die Versorgungsqualität insgesamt zu verbessern.
„In einem nächsten Schritt möchten wir unsere erhobenen Daten gesundheitsökonomisch analysieren und prüfen, welche Kosteneinsparungen für das Gesundheitssystem durch telemedizinische Mitbetreuung möglich sind. Zudem untersuchen wir ein Jahr nach dem Studienende, ob telemedizinische Mitbetreuung auch nach ihrem Abschluss einen nachhaltigen Einfluss auf den Krankheitsverlauf hat“, ergänzt Prof. Köhler.
*Koehler F et al. Efficacy of Telemedical Interventional Management in Patients with Heart Failure (TIM-HF2): a randomised, controlled, parallel-group, unmasked trial, Lancet 2018. DOI 10.1016/S0140-6736(18)31880-4.
Forschungsprojekt „Gesundheitsregion der Zukunft Nordbrandenburg – Fontane“
Das Projekt „Gesundheitsregion der Zukunft Nordbrandenburg – Fontane“ wurde von 2009 bis 2018 vom Bundesministerium für Bildung und Forschung mit 10,2 Millionen Euro gefördert. Darüber hinaus hat das Land Brandenburg die technische Entwicklung des in der Studie verwendeten Telemedizinsystems mit 4,5 Millionen Euro unterstützt. Projektpartner sind die GETEMED Medizin- und Informationstechnik AG, die Deutsche Telekom Healthcare and Security Solutions GmbH, die Hasso-Plattner-Institut für Softwaresystemtechnik GmbH, die Thermo Fisher Scientific Clinical Diagnostics Brahms GmbH sowie die assoziierten Kooperationspartner AOK Nordost und BARMER.