Verschiedenste Erscheinungsformen von Immunzellen im menschlichen Gehirn erstmalig identifiziert
Besondere Subform der Immunwächter bei Hirntumoren entdeckt / Studie im Fachmagazin Nature Neuroscience erschienen
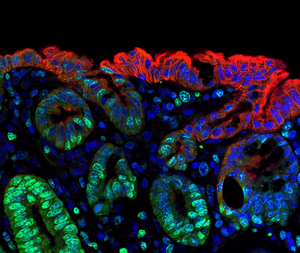
Bildrechte: Roman Sankowski / Universitätsklinikum Freiburg
Ein internationales Forscherteam unter Leitung des Universitätsklinikums Freiburg, des Max-Planck-Instituts für Immunbiologie und Epigenetik Freiburg sowie der Charité – Universitätsmedizin Berlin, hat das hirneigene Immunsystem des Menschen im gesunden und erkrankten Gehirn neu vermessen. Dabei fanden die Forscherinnen und Forscher überraschend viele unterschiedliche Erscheinungsformen von Immunzellen, Mikroglia genannt. Mit neuartigen, hochauflösenden Techniken untersuchte das Team aus Freiburg und Berlin die Bausteine und den Stoffwechsel einzelner Immunzellen im Hirngewebe. So wiesen sie detailliert nach, wie sich das menschliche Immunsystem bei Hirntumoren verändert, was für zukünftige Therapieansätze von Bedeutung sein dürfte. Die Studie erschien am 18. November 2019 im Fachmagazin Nature Neuroscience.
„Wir waren sehr überrascht zu sehen, in wie vielen unterschiedlichen Erscheinungsformen Mikrogliazellen im menschlichen Gehirn zu finden sind. Der Zustand der Zellen wird offensichtlich stark durch Faktoren wie Altern, Tumoraktivität und umgebende Zellen beeinflusst“, sagt Projektleiter Prof. Dr. Marco Prinz, Ärztlicher Direktor des Instituts für Neuropathologie am Universitätsklinikum Freiburg und Mitglied im Exzellenzcluster CIBBS – Centre for Integrative Biological Signalling Studies der Albert-Ludwigs-Universität Freiburg. „Die Vielfalt der Immunzellen eröffnet neue Therapieansätze gegen Hirntumoren oder neurodegenerative Erkrankungen“, fasst Prinz zusammen. Für ihre Studie werteten die Forscher Gewebeproben von 15 Patienten aus, bei denen aufgrund einer Epilepsie oder eines Tumors Hirngewebe entnommen werden musste. Frühere Studien an Nagergehirnen waren zu dem Schluss gekommen, dass Mikroglia nur wenige unterschiedliche Aktivitätszustände einnehmen können.
Mikroglia, die Immunwächter im Gehirn, übernehmen während der Hirnentwicklung wie auch im gesunden und kranken Erwachsenengehirn viele verschiedene Aufgaben, von der Ernährung bis hin zur Gewebereparatur. In den letzten Jahren wird diesen hirneigenen Immunwächtern zunehmend auch eine wichtige Rolle bei der Entstehung zahlreicher degenerativer Hirnerkrankungen wie Alzheimer, Parkinson aber auch bei entzündlichen Erkrankungen wir Multipler Sklerose und bei Hirntumoren zugeschrieben. Daher sind Wissenschaftler weltweit sehr daran interessiert, Mikrogliazellen detaillierter zu verstehen, um diese zukünftig gezielt therapeutisch verändern zu können.
Eine Manege voll von verschiedenen Immunwächtern bei Hirntumoren
Detailliert verglichen die Forscher um Prinz und Dr. Dominic Grün, Forschungsgruppenleiter am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg, gemeinsam mit den Erstautoren der Studie, Dr. Roman Sankowski vom Institut für Neuropathologie des Universitätsklinikums Freiburg, und Dr. Chotima Böttchervon der Charitè Universitätsmedizin Berlin, die unterschiedlichen Zustände der Mikrogliazellen in menschlichen Hirntumoren. Bislang wurde angenommen, dass es vor allem im Blut zirkulierende Immunzellen sind, die in Hirntumoren zu finden sind. Sankowski konnte zeigen, dass es im Hirntumorgewebe speziell aktivierte hirneigene Mikrogliazellen gibt. Diese Zellen unterscheiden sich von anderen Mikroglia in zellulärer Ausstattung und Zellstoffwechsel. „Wir haben die Hoffnung, dass jetzt neue zellspezifischere und nebenwirkungsarme Therapieansätze entwickelt werden können, mit denen sich Tumorerkrankungen besser behandeln lassen“, sagt Sankowski.
Mit Laser und Molekularanalyse die Zelle erforschen
Die Untersuchung wurde dank neu entwickelter Einzelzell-Analysen (englisch single cell analyses) möglich. Damit ermittelten die Forscher anhand von RNA-Analysen die Genaktivität und mittels Lasermessung die Proteinausstattung einzelner aus dem Hirngewebe extrahierter Zellen. „Mit diesen Methoden erhalten wir ein wesentlich präziseres zelluläres Bild von sehr komplexen Geweben wie dem Hirn und darin stattfindende Veränderungen“, sagt Grün, einer der Entwickler dieser Technik. „Deshalb dürften die Methoden ein enormes Potenzial für die medizinische Diagnostik haben“, so Grün.
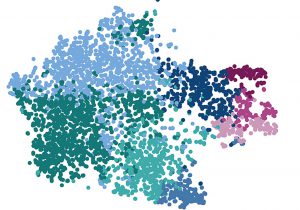
Bildunterschrift: Einzelzellanalyse von Mikrogliazellen: Jeder Punkt zeigt eine Zelle und die Farben signalisieren verschiedene Gruppen von Mikrogliazellen, wie sie im menschlichen Gehirn vorkommen.
Bildrechte: Roman Sankowski / Universitätsklinikum Freiburg
Originaltitel der Studie: Mapping microglia states in the human brain through the integration of high-dimensional techniques.
DOI: 10.1038/s41593-019-0532-y
Link zur Studie: https://www.nature.com/articles/s41593-019-0532-y