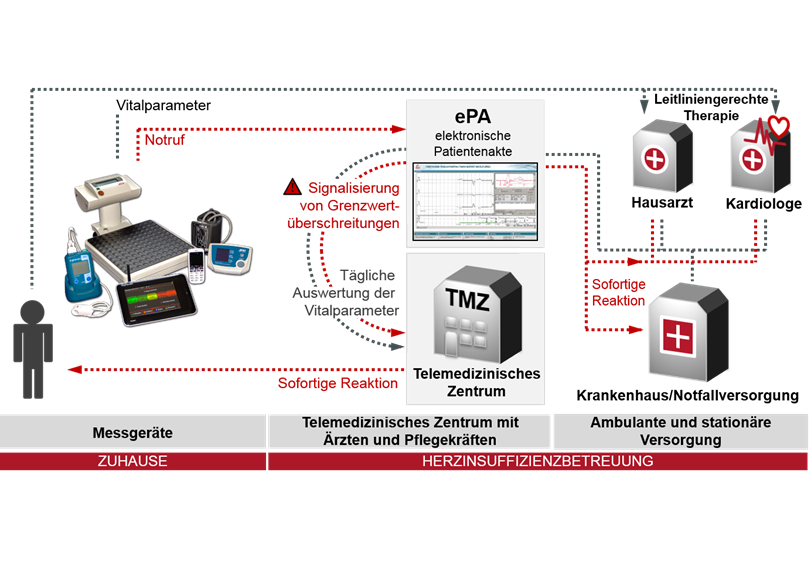
Wissenschaftler decken den Wirkungskreislauf von Epo in Nervenzellen auf
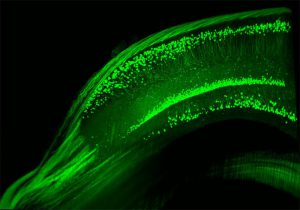
der Gabe von Erythropoietin weisen die Tiere mehr
Nervenzellen in dieser für Lernen und Gedächtnis
zentralen Gehirnregion auf.
© MPI f. Psychiatrie
Erythropoietin, kurz Epo, ist ein berüchtigtes Dopingmittel. Es fördert die Bildung von roten Blutkörperchen und steigert – wie man bislang glaubte – auf diese Weise die körperliche Leistungsfähigkeit. Der Wachstumsfaktor schützt und regeneriert aber auch Nervenzellen im Gehirn. Forscher vom Max-Planck-Institut für experimentelle Medizin in Göttingen haben nun herausgefunden, wie Epo dort wirkt. Sie haben entdeckt, dass geistige Herausforderungen in den Nervenzellen des Gehirns einen leichten Sauerstoffmangel (von den Forschern ‚funktionelle Hypoxie‘ genannt) auslösen. Dies regt die Produktion von Epo und seinen Rezeptoren in den aktiven Nervenzellen an. Dadurch werden aus benachbarten Vorläuferzellen neue Nervenzellen gebildet, und die Zellen verbinden sich effektiver untereinander.
Erythropoietin ist ein Wachstumsfaktor, der unter anderem die Produktion von roten Blutkörperchen anregt. So fördert es bei Anämie-Patienten die Blutbildung. Darüber hinaus wird der hochpotente Wirkstoff auch zur illegalen Leistungssteigerung im Sport eingesetzt.
„Die Gabe von Epo verbessert die Regeneration nach einem Schlaganfall (genannt ‚Neuroprotektion‘ und ‚Neuroregeneration‘) und verringert so die Schäden im Gehirn. Patienten mit Störungen der geistigen Leistungsfähigkeit im Rahmen von Schizophrenie, Depression, Bipolarer Erkrankung oder Multipler Sklerose, die wir mit Epo behandelt haben, sind zudem deutlich leistungsfähiger“, sagt Hannelore Ehrenreich vom Max-Planck-Institut für experimentelle Medizin. Die Wissenschaftlerin erforscht zusammen mit ihren Kollegen seit Jahren die Rolle von Epo im Gehirn.
Mehr Nervenzellen
Ehrenreich und ihr Team haben nun in Tierversuchen an Mäusen systematisch untersucht, welcher körpereigene Mechanismus der höheren Leistungsfähigkeit des Gehirns nach Epo zugrunde liegt. Ihre Versuchsergebnisse zeigen, dass erwachsene Mäuse nach der Gabe des Wachstumsfaktors 20 Prozent mehr Nervenzellen in der Pyramidenschicht des Hippocampus, einer für Lernen und Gedächtnis entscheidenden Hirnregion, bilden. „Außerdem vernetzen sich die Nervenzellen besser und schneller mit anderen Nervenzellen und tauschen dadurch effizienter Signale aus“, sagt Ehrenreich.
Die Forscher ließen die Mäuse auf Laufrädern trainieren, deren Speichen in unregelmäßigen Abständen angeordnet waren. „Das Laufen in diesen Rädern erfordert das Erlernen komplexer Bewegungsabläufe, die für das Gehirn eine besondere Herausforderung sind“, erklärt Ehrenreich. Die Resultate belegen, dass die Mäuse nach einer Epo-Behandlung die für die Laufräder erforderlichen Bewegungen schneller lernen. Die Nager sind darüber hinaus deutlich belastbarer.
Höherer Sauerstoffbedarf
Den Göttinger Wissenschaftlern war nun das Verständnis der Mechanismen wichtig, welche diese potenten Epo Effekte erklären. Sie wollten der physiologischen Bedeutung des Epo-Systems im Gehirn auf die Spur kommen. In einer Reihe gezielter Experimente konnten sie belegen, dass Nervenzellen beim Lernen komplexer motorischer Aufgaben mehr Sauerstoff benötigen, als ihnen normalerweise zur Verfügung steht. Der dadurch entstehende leichte Sauerstoffmangel (relative Hypoxie) liefert in den Nervenzellen das Signal zur vermehrten Epo-Produktion. „Es handelt sich hierbei um einen selbstverstärkenden Prozess: Geistige Anstrengung führt zu leichter Hypoxie, von uns als ‚funktionelle Hypoxie‘ bezeichnet, der wiederum die Produktion von Epo und seinen Rezeptoren in den entsprechend aktiven Nervenzellen anregt. Epo steigert anschließend die Aktivität dieser Nervenzellen, bewirkt die Bildung neuer Nervenzellen aus benachbarten Vorläuferzellen, und erhöht deren komplexe Vernetzung, um auf diese Weise zu der bei Mensch und Maus messbaren Verbesserung der geistigen Leistungsfähigkeit zu führen“, erklärt Ehrenreich.
Der selbstverstärkende Zyklus aus geistiger Herausforderung, aktivitätsinduzierter Hypoxie und Epo-Produktion kann auf unterschiedliche Weise beeinflusst werden: „Die geistige Leistungsfähigkeit lässt sich durch konsequentes Lernen und geistiges Training über die Epo-Produktion der beteiligten Nervenzellen steigern. Ein ähnlicher Effekt wird bei Kranken durch die Verabreichung von zusätzlichem Epo erzielt“, sagt Ehrenreich.