Per Erbgut-Schalter Alzheimer aufhalten
Forscher des Universitätsklinikums Freiburg finden Mechanismus, mit dem im Mausmodell Alzheimer-typische Veränderungen reduziert werden konnten / Dafür klären sie die epigenetische Steuerung von Immunzellen des Gehirns / Studie im Fachmagazin Immunity
 Durch das gezielte Ausschalten zweier Gene lässt sich das Fortschreiten der Alzheimer-Krankheit aufhalten und die kognitive Leistung verbessern. Das haben jetzt Wissenschaftlerinnen und Wissenschaftler des Universitätsklinikums Freiburg bei Mäusen gezeigt, die Alzheimer-ähnliche Veränderungen des Gehirns aufwiesen. Die Forscher veränderten das Erbgut von Immun-Fresszellen im Gehirn, den sogenannten Mikrogliazellen. Dadurch veränderten sich die Fresszellen funktionell und entfernten mehr von den schädlichen Eiweißablagerungen, die bei Alzheimer zur Schädigung des Gehirns führen. Die beiden ausgeschalteten Gene gehören zur epigenetischen Steuerung und regulieren, welche Gene wann wie stark abgelesen werden. Bislang war über diese Steuerung bei Mikroglia wenig bekannt. Die Erkenntnisse der Freiburger Forscher könnten Grundlage für neue Therapien bei neurodegenerativen Erkrankungen werden. Die Studie erschien am 13. März 2018 in der Fachzeitschrift Immunity.
Durch das gezielte Ausschalten zweier Gene lässt sich das Fortschreiten der Alzheimer-Krankheit aufhalten und die kognitive Leistung verbessern. Das haben jetzt Wissenschaftlerinnen und Wissenschaftler des Universitätsklinikums Freiburg bei Mäusen gezeigt, die Alzheimer-ähnliche Veränderungen des Gehirns aufwiesen. Die Forscher veränderten das Erbgut von Immun-Fresszellen im Gehirn, den sogenannten Mikrogliazellen. Dadurch veränderten sich die Fresszellen funktionell und entfernten mehr von den schädlichen Eiweißablagerungen, die bei Alzheimer zur Schädigung des Gehirns führen. Die beiden ausgeschalteten Gene gehören zur epigenetischen Steuerung und regulieren, welche Gene wann wie stark abgelesen werden. Bislang war über diese Steuerung bei Mikroglia wenig bekannt. Die Erkenntnisse der Freiburger Forscher könnten Grundlage für neue Therapien bei neurodegenerativen Erkrankungen werden. Die Studie erschien am 13. März 2018 in der Fachzeitschrift Immunity.
„Die behandelten Tiere mit Alzheimer-Symptomen erzielten deutlich verbesserte Lern- und Erinnerungsleistungen. Sie erreichten nahezu die Werte gesunder Tiere“, sagt Studienleiter Prof. Dr. Marco Prinz, Ärztlicher Direktor des Instituts für Neuropathologie am Universitätsklinikum Freiburg. „Durch das Ausschalten der Gene nahmen die Mikroglia-Fresszellen mehr Alzheimer-typische Ablagerungen im Gehirn auf, wodurch sich die Menge dieser Ablagerungen deutlich verringerte.“ Abgesehen von der erwünschten Erhöhung der Fressaktivität verhielten sich die Zellen normal.
Mikroglia räumen im Gehirn auf
Mikroglia sind gehirnspezifische Makrophagen oder Fresszellen. Sie räumen während der Reifung des Gehirns nicht funktionierende Zellen ab und schützen Nervenzellen vor Krankheitserregern. Es wird aber auch angenommen, dass Mikroglia eine entscheidende Rolle bei Krankheiten wie Alzheimer, Multiple Sklerose oder bestimmten psychiatrischen Erkrankungen wie Autismus und Schizophrenie spielen. Dabei können unvollständig aktivierte Mikroglia ebenso wie übermäßig aktivierte Zellen zu einer Hirnschädigung beitragen.
Fresszellen fressen besser dank epigenetischer Veränderung
Für die Entwicklung und Regulation von Zellen spielen neben genetischen Informationen, welche in der DNA der Zelle kodiert sind, epigenetische Veränderungen eine entscheidende Rolle. Diese haben Einfluss darauf, welche DNA-Abschnitte wann und wie stark abgelesen werden. Das Team des Instituts für Neuropathologie am Universitätsklinikums Freiburg um Prof. Prinz, die Wissenschaftlerin Dr. Moumita Datta und den Neuropathologen Dr. Ori Staszewski schalteten jetzt zwei dieser epigenetischen Faktoren aus, so genannte Histondeacetylasen (Hdac1 und Hdac2). Dadurch wurden mehr Gene abgelesen, die das Fressverhaltender Zellen lenken. „Die Epigenetik ist von entscheidender Bedeutung für die Entwicklung und Funktion von Mikrogliazellen“, sagt Prof. Prinz.
Wie die Freiburger Forscher aber auch feststellten, wird die Reifung der Mikroglia gehemmt, wenn die Gene bereits während der Gehirnreifung fehlen. „Ohne die Funktion dieser epigenetischen Faktoren nimmt die Zahl der Mikroglia während der Hirnentwicklung ab und die Zellen reifen nicht normal aus“, sagt Dr. Staszewski.
Die Arbeit ist Teil des Sonderforschungsbereichs „Medizinische Epigenetik (MedEp)“ (SFB 992). Ziel dieser Forschungsinitiative ist es, grundlegende Mechanismen epigenetischer Regulation zu untersuchen und die gewonnenen Erkenntnisse in klinische Anwendungen zu übertragen.
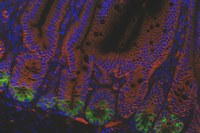
Bildunterschrift: Fresszellen des Gehirns (Mikroglia – in rot) interagieren mit Ablagerungen (Amyloidplaques – in grün) im Rahmen der Alzheimer-Erkrankung und nehmen diese in sich auf.
Bildquelle: Universitätsklinikum Freiburg
Originaltitel der Studie: Histone Deacetylases 1 and 2 Regulate Microglia Function during Development, Homeostasis, and Neurodegeneration in a Context-Dependent Manner.
DOI: 10.1016/j.immuni.2018.02.016
Link zur Studie: http://www.cell.com/immunity/fulltext/S1074-7613(18)30075-X